
|
Argentina, la
lucha continua....
|
|
|
Omisiones del SENASA e inconsistencias de los ensayos de laboratorio presentados por Monsanto
La semilla Soja Intacta y su aprobaci�n en Argentina
CELMA
Para la aprobaci�n de la Soja Intacta en los pa�ses de Argentina, Uruguay y Brasil, Monsanto presento ante los �rganos competentes tres estudios de laboratorio en roedores para la evaluaci�n de riesgos sobre toxicidad aguda, cr�nica y carcinog�nesis.
En Argentina, el CELMA tuvo acceso a esos ensayos de laboratorio, tras una orden judicial; lo que le permiti� realizar un an�lisis y control de los mismos. Ante todo debe se�alarse que no existen standares internacionales obligatorios para los estudios de laboratorio con roedores sobre toxicidad cr�nica, aguda y carcinogenicidad de los �rganos Vegetales Modificados Gen�ticamente (OVGM). Por lo general los laboratorios y cient�ficos deben ajustar su proceder con las buenas pr�cticas de laboratorio (BPL) a fin de que sus trabajos puedan ser considerados validos como asi tambien los procedimientos aplicados.
En ese sentido la OCDE, Organizaci�n para la Cooperaci�n y el Desarrollo Econ�mico (OCDE) fue creando en general directivas sobre estudios de toxicidad cronica y aguda, que con el tiempo fueron adquiriendo importancia; y hoy sus pautas si bien no son obligatorias, se han transformado en referencias validas aceptadas mundialmente e insertadas como premisas de BPL.
La OCDE es una organizaci�n de cooperaci�n internacional, compuesta por 34 pa�ses (Argentina no es miembro, pero en el a�o 1997 adhiri� a la declaraci�n sobre inversi�n internacional y empresas multinacionales).
Por nuestra parte conservamos una mirada cr�tica sobre la OCDE, ya que por a�os ciertas pautas impartidas por el organismo han beneficiado solapadamente a las industrias alimenticia y biotecnologica, estableciendo normas laxas y flexibles sobre toxicidad cronica en los ensayos de laboratorio, acomodadas a las necesidades de dichas industrias y en detrimento de una mirada prudente y precautoria que exige el establecimiento de normas cuyo objeto sea la protecci�n de la salud humana.
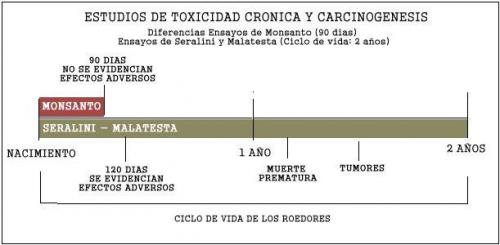
En efecto, durante muchos a�os para los estudios de toxicidad cr�nica, la industria alimenticia y biotecnologica utilizaron para sus ensayos de laboratorio la Directiva 408 de la OCDE. Dicha directiva establec�a para los estudios de toxicidad cr�nica el escaso plazo de 90 d�as.- Es dable recalcar que la toxicidad cr�nica refiere a la contaminaci�n que se produce por consumir un producto en peque�as dosis durante tiempos largos y cuyos efectos pueden evidenciarse despues de muchos a�os, por lo tanto, los dise�os de ensayos deben comprender un lapso considerable del ciclo de vida de los animales de laboratorio. Siendo que los roedores tienen un ciclo de vida de 24 meses promedio (730 dias), considerar solo 90 dias (no mas del 15 %) del ciclo de vida del animal para analizar los riesgos de toxicidad cronica, es absolutamente insuficiente.
Esto ultimo quedo evidenciado en las conclusiones de algunos estudios de toxicidad cr�nica a largo plazo (ciclo de vida de los animales roedores -2 a�os- ) sobre los OVGM realizados por investigadores cient�ficos europeos, que demostraron que a partir del 4 mes (120 dias) se observaron efectos adversos. Con ello quedo clara la laxitud de las normas de la Directiva 408 de la OCDE al fijar un plazo exiguo de 90 d�as, generando una fuerte incertidumbre cient�fica sobre la inocuidad alimentaria de los productos aprobados con aquella directriz.
S�ralini et al., 2008
Autores: G.-E. S�ralini, D. Cellier, JS deVend�mois Un nuevo an�lisis de un estudio de alimentaci�n de ratas con unma�z modificado gen�ticamente revela signos de toxicidad hepatorrenal Publicadoen Arco. Environ. Contam. Toxicol., 52 (2007), pp 596-602 Experimentos m�s largos son esenciales para indicar la verdadera naturaleza y el alcance de laposible patolog�a, con los datos actuales no se puede concluir que el ma�z transg�nico MON863 es un producto seguro.
Link: http://www.ncbi.nlm.nih.gov/pubmed/17356802
Malatesta et al., 2008 Autores: M. Malatesta, F. Boraldi, G.Annovi, B. Baldelli, S.Battistelli, M. Biggiogera, D. Quaglino Un estudio a largo plazo e ratoneshembras alimentadas con una soja modificada gen�ticamente: efectos sobre elenvejecimiento del h�gado Publicado en Histochem.Cell Biol..,130 (2008), pp 967-977 Resumen: Este estudio de muestra que la ingesta de soja GM puede influir sobre algunas de las caracter�sticas del h�gado durante el envejecimiento y, aunque los mecanismos siguen siendo desconocidos,subraya la importancia de investigar las consecuencias a largo plazo deGM-dietas y los posibles efectos sin�rgicos con el envejecimiento, xenobi�ticos y / o condiciones de estr�s. LinK: http://www.ncbi.nlm.nih.gov/pubmed/18648843
Ante las conclusiones de dichos estudios, la OCDE en el a�o 2009 se vio obligada a dictar nuevas directivas (452 Y 453) sobre estudios de toxicidad cr�nica y carcinogenicidad previendo plazos de 365 y 730 d�as respectivamente y fijando que los ensayos deber�n ser dise�ados en una base de caso por caso.
Monsanto Argentina SAIC para la aprobaci�n del evento Soja Intacta en Argentina present� a los efectos del an�lisis de toxicidad cr�nica y cancigenorecidad dos ensayos:
1) estudio de Alimentaci�n de 90 d�as, de ratas alimentadas con comida de soja resistente a insectos MON89788


2) estudio de Alimentaci�n de 90 d�as, de ratas alimentadas con comida de soja resistente a insectos MON87701 89788



Como se observa claramente en los documentos adjuntados, Monsanto no present� un estudio de toxicidad cr�nica y carcinogenicidad que comprenda integramente el evento SOJA MON89788 x MON87701 asimismo lo hizo en plazos cortos de 90 dias.
Caso por Caso
Monsanto sobre la Soja Intacta presento estudios de los eventos apilados MON89788 y MON87701 en forma individual con un detalle grave en uno de ellos, en el evento MON 87701 (Resaltado) refiere a otro eventos distintos, primero 89024, luego a 88017 y por ultimo 89034. Lo cual muestra una clara incongruencia del documento y una falta absoluta de control por el organo tecnico SENASA (en materia de inocuidad alimentaria) en el procedimiento administrativo de aprobacion en la Argentina.
La OCDE 453 TG es clara en el Punto 4 al se�alar que "los estudios deber�n ser dise�ados en una base de caso por caso". La EFSA siguiendo los pasos de la OCDE 453 TG, recomend� en su informe cient�fico que la decisi�n de realizar estudios de toxicidad y/o carcigonecidad con alimentos integrales para consumo humano / animal se deber�a tomar sobre una base de caso por caso. Se deber�a basar en la evaluaci�n de toda la informaci�n disponible sobre los alimentos integrales para consumo humano / animal resultante de an�lisis composicionales y otros estudios nutricionales y toxicol�gicos disponibles.
En tal sentido la Resoluci�n 412/02 establece en el art 7) que se llevar� a cabo una evaluaci�n de inocuidad del alimento, siguiendo un m�todo estructurado e integrado que se aplicar� caso por caso, con anterioridad a su salida al mercado.
Es importante se�alar que aun cuando la norma 7) Resoluci�n 412/02 sea acertada al contener la prevenci�n del caso por caso, es muy laxa al se�alar a posteriori que "los datos e informaciones deben estar basados en s�lidos principios cient�ficos, obtenidos usando m�todos apropiados y analizados mediante adecuadas t�cnicas estad�sticas, debiendo ser de calidad y cantidad suficientes que permitan realizar una evaluaci�n cient�fica"; dado que debi� especificar con detalles los m�todos apropiados y las adecuadas t�cnicas estad�sticas.
Es cierto que la Argentina no es parte de la OCDE, pero nada impide que una resoluci�n pueda remitir a las directrices de la OCDE TG 453. Ese vac�o de la Resoluci�n 412/02 importa una clara desprotecci�n a la salud de los ciudadanos, dado que permite que las empresas realicen los estudios a su arbitrio.
De lo que se observa de los ensayos adjuntados por la empresa Monsanto Argentina SAIC para la aprobacion de la Soja Intacta es que no sigui� directrices uniformes en los estudios realizados en forma individual sobre cada evento apilado (en uno lo hizo con cinco grupos de 12/12 con una formulaci�n al 30 % y en el otro evento en tres grupos de 20/20 al 11% y 33 %), lo �nico que se mantuvo uniforme fue el plazo de duraci�n de los estudios 90 d�as, ello es, conforme la OCDE 408 (que quedo en desuso en el a�o 2009), cuando en realidad debi� haber aplicado las prescripciones de la OCDE TG 452 y 453.
Plazos largos en los ensayos para analizar riesgos de toxicidad cronica y carcinogeneticos.
Como ya se adelanto, la OCDE 408 fijo las Directrices para los ensayos de productos qu�micos en roedores de estudios de toxicidad cr�nica con un plazo de 90 d�as, que fue modificada en el a�o 2009 por la OCDE 452 luego integrada a la OCDE 453 TG que fija las directrices para los ensayos de productos qu�micos en estudios de toxicidad cr�nica y carcinogenicidad con un plazo de 12 meses (365 d�as) y 24 de meses (730 d�as) respectivamente (Los ensayos de Monsanto en el 2010 solo comprendieron 90 dias). Asimismo establece un dise�o de 10 roedores de cada sexo por grupo. (Monsanto utilizo 12 en uno y 20 en otro). NADA DE ESTO FUE OBSERVADO POR EL SENASA.
De lo que surge de la documental obrante en las actuaciones administrativas de la Secretaria de Agricultura de la Naci�n sobre la Soja Intacta, Monsanto Argentina SA realizo la petici�n de aprobaci�n del evento el 14 Diciembre de 2010, cuando ya reg�an las directrices de la OCDE 452 y 453.

En cuanto a los estudios sobre toxicidad aguda (prote�na CP4 EPSPS) Monsanto presenta un trabajo realizado en el a�o 1993 por Naylor, en el que se se�ala las reglas que se siguieron para su desarrollo: se administro como dosis simple por entubaci�n forzada a grupos de diez ratones en dosis de 59, 154 y 572 mg.
Un grupo denominado control de veh�culo de 10 ratones/sexo recibi� solo la substancia veh�culo que consisti� en dosis de 33 ml/kg de una soluci�n de bicarbonato de sodio 50MM. otro grupo de control (tambi�n denominado control de veh�culo en las tablas) de diez ratones/sexo recibi� seroalbumina bovina (BSA) a una dosis de 363 mg/kg (tambien a 33,33 ml/KG; dosis objetivo fue de 400 mg/kg)


Que tales par�metros, son absolutamente arbitrarios y no cumplen con ningunos de los protocolos de la OCDE, ni 420,423 y 425 sobre toxicidad aguda.
Las reglas de la OCDE 420 (m�todo dosis fija), Esta Gu�a est� destinada principalmente para su uso con la rata. Los grupos de animales de un mismo sexo (normalmente hembras) se dosifican en una manera gradual las dosis fijas de 5, 50, 300 y 2000 mg / kg (excepcionalmente 5,000 mg / kg). El nivel de dosis inicial se selecciona sobre la base de un estudio preliminar como la dosis espera para producir algunos signos de toxicidad sin causar efectos t�xicos graves o la mortalidad. Otros grupos de animales se pueden dosificar en dosis altas o m�s bajas, dependiendo de la presencia o ausencia de signos de toxicidad o mortalidad. Este procedimiento contin�a hasta que se identifica la dosis que causa toxicidad manifiesta o la muerte, o cuando no hay efectos se ven en la dosis m�s alta o cuando ocurren muertes a la dosis m�s baja. La sustancia de ensayo se administra en una dosis �nica por alimentaci�n forzada mediante sonda g�strica o una c�nula de intubaci�n adecuada. Los animales deben estar en ayunas antes de la administraci�n. Un total de cinco animales de un sexo normalmente se utilizar� para cada nivel de dosis investigado. http://www.oecd-ilibrary.org/environment/test-no-420-acute-oral-toxicity-fixed-dose-procedure_9789264070943-en
Las reglas de la OCDE 423 deben usarse tres animales para cada paso. Se debe seleccionar el nivel de dosis para ser utilizada como la dosis de partida a partir de uno de los cuatro niveles fijos, 5, 50, 300 y 2.000 mg / kg de peso corporal. La dosis inicial debe ser lo que es m�s probable para producir la mortalidad en algunos de los animales dosificados. . Cuando la informaci�n disponible sugiere que la mortalidad es poco probable en el nivel de dosis m�s alto de partida (2000 mg / kg de peso corporal), a continuaci�n, debe llevarse a cabo un ensayo l�mite. Cuando no hay informaci�n sobre una sustancia a ensayar, por razones de bienestar animal, se recomienda utilizar la dosis inicial de 300 mg / kg peso corporal. http://www.oecd-ilibrary.org/docserver/download/9742301e.pdf?expires=1381156303&id=id&accname=guest&checksum=3BD0616E6EA6A2BEA888C2D0988A4944
Las reglas de la OCDE 425. Esta TG est� dise�ado para su uso con los roedores (ratas hembra preferentemente). Hay una prueba de l�mite y una prueba principal. El ensayo l�mite se puede utilizar de manera eficiente para identificar los productos qu�micos que son propensos a tener baja toxicidad. La sustancia de ensayo se administra generalmente en una dosis �nica por alimentaci�n forzada a animales en ayunas antes de la dosificaci�n. Animales individuales se dosifican en secuencia por lo general a intervalos de 48h. El primer animal se dosifica un paso por debajo de las mejores estimaciones preliminares de la DL50.El segundo animal recibe una dosis m�s baja (si el primer animal muere) o una dosis m�s alta (si el primer animal sobrevive). Los animales se observan con una atenci�n especial durante las primeras 4 horas y diariamente a partir de entonces, para un total de 14 d�as en general. http://www.oecd-ilibrary.org/environment/test-no-425-acute-oral-toxicity-up-and-down-procedure_9789264071049-en
Que la Resoluci�n 402/12 al no fijar que directrices deben seguirse, ni el SENASA haber recepcionado los importantisimos cambios relacionados con los ensayos de toxicidad cronida y carcinogenicidad en laboratorio, ni reparado en las inoberservancias en los ensayos de toxicidad aguda permite el obrar arbitrario de las empresas solicitantes.
Es decir, el SENASA no dio cuenta de las directrices de la OCDE TG 420, 423, 425, 452 y 453, tampoco realizo observaci�n alguna convalidando los ensayos presentados por Monsanto (realizados conforme reglas elegidas a su arbitrio) y a su vez no considero la informaci�n cient�fica de los estudios de otros investigadores (como los citados mas arriba) que siguiendo un procedimiento cientifico adecuado (ensayos a largo plazo) los resultados indican la existencia de riesgos concretos a la salud humana de los OVGM.
A ello se suma la imposibilidad de la comunidad en general de poder participar en un proceso de consultas o audiencias publicas dentro del procedimiento administrativo de aprobaci�n de los OVGM, a los efectos de presentar las objeciones fundadas en los estudios que develan la existencia de riesgos, para que sean considerados por la autoridad de contralor en biotecnolog�a al momento de dictar la resoluci�n administrativa pertinente.-
Conclusiones
La OCDE creo directrices m�s rigurosas a trav�s de la normas OCDE 452,453 sobre los estudios de toxicidad cr�nica y carcinogenicidad . Asimismo la EFSA, autoridad de seguridad alimentaria de Europa dio cuenta de ello y publico un reporte en Julio de 2013 en la cual fija recomendaciones para los mismos estudios remitiendo a la OCDE 453.
Sobre esto ultimo, la EFSA fue determinante "los par�metros a considerar tanto para la fase de toxicidad cr�nica como la para la fase de carcinogenicidad deber�an estar en l�nea con los detallados en la OECD TG 453. Se deber�an considerar marcadores adicionales de efectos nutricionales y/o metab�licos potencialmente adversos sobre una base caso por caso, de acuerdo con el conjunto de evidencia disponible y el tipo de alimentos integrales para consumo humano/animal que se est�n investaci�n". Asimismo agrega que deber�a incluirse un capitulo especifico sobre el an�lisis de las suposiciones eincertidumbres.
Que tales nuevas reformulaciones (tanto de la OCDE en el a�o 2009 y la EFSA en el 2013) importan un cambio transcendental en los an�lisis de riesgos de los OVGM. Ese cambio pas� absolutamente inadvertido por las autoridades argentinas en materia de biotecnolog�a como los �rganos t�cnicos (SENASA – CONABIA). El SENASA (No asi la CONABIA –Res.701/11-) esta obligada por la Resoluci�n 412/02 a recepcionar e incorporar la nueva informaci�n cient�fica que surja en relaci�n a la evaluaci�n de riesgos de los OVGM a fin de adaptar las medidas de gesti�n de riesgos.
El art 15) de la Resoluci�n 412/02 es claro en ese sentido:
"Teniendo en cuenta el r�pido desarrollo de la biotecnolog�a se revisar�, cuando sea necesario, el criterio de evaluaci�n de inocuidad aplicado a los alimentos obtenidos por medios biotecnol�gicos modernos, para asegurar que la informaci�n cient�fica m�s reciente se incorpore al an�lisis de riesgos. Cuando se obtenga nueva informaci�n cient�fica de inter�s para la evaluaci�n de riesgos, esta �ltima se revisar� para incorporar la informaci�n en cuesti�n y, de ser necesario, se adaptar�n en consecuencia las medidas de gesti�n de riesgos."
Asimismo la Resoluci�n 412 /02 obliga a un reexamen de la evaluaci�n de inocuidad frente a las nuevas informacionescient�ficas que pongan en tela de juicio las conclusiones de la evaluaci�n original.
El Art 52) de la Res 412/02 tambien es por demas elocuente:
"La evaluaci�n de inocuidad deber�r eexaminarse a la luz de las nuevas informaciones cient�ficas que puedan poneren tela de juicio las conclusiones de la evaluaci�n original".
A merito de lo expuesto es inobjetable que los an�lisis de riesgos de los OVGM (toxicidad cr�nica y carcigonecidad) deben realizarse por plazos largos (ciclo de vida de los animales de laboratorio). Asimismo los estudios de toxicidad aguda deben adecuarse a las nomas actuales de la OCDE.
Sobre el evento Soja Intacta, la empresa Monsanto eligio pautas para sus ensayos de modo absolutamente arbitrario que est�n enajenadas de las nuevas directivas de la OCDE 453 (en lo que refiere a toxicidad cr�nica y carcigenogecidad) y OCDE 420,423 y 425 (en toxicidad aguda). Debe darse relevancia que sobre los efectos cronicos, al soslayar Monsanto las directivas actualizadas de la OCDE, logro ocultar datos que se evidenciaron en estudios a plazos largos (24 meses), generando una incertidumbre cientifica sobre la inocuidad alimentaria de los OVGM aprobados en plazos cortos (90 dias).
Es en base al principio precautorio regulado en el art 4 de la ley general de Ambiente 25.675 que en raz�n de esa incertidumbre cient�fica y las omisiones manifiestas del SENASA corresponde la adopci�n de una serie de medidas eficaces oportunas que no pueden postergarse por cuestiones de costos, ello es: 1) la suspensi�n del evento Soja Intacta por carecer de an�lisis integral y real sobre su inocuidad alimentaria; 2) la adecuaci�n -por parte del Estado- de las normas de aprobaci�n de las semillas transg�nicas a la nueva informaci�n cient�fica (Directrices de la OCDE TG 453 y de la EFSA) y 3) obligar -en consencuencia- a las empresas biotecnol�gicas a que cumplan con las directivas de las pautas de la OCDE en los estudios y ensayos de laboratorio, para as� poseer una debida y real garant�a de inocuidad alimentaria que hoy conforme esos est�ndares internacionales, de modo inequ�voco carecen.
Centro de Estudios Legales del Medio Ambiente. CELMA